- ACIDES-ALCOOLS
- ACIDES-ALCOOLSUn acide-alcool est une molécule renfermant au moins une fonction acide carboxylique et une fonction alcool.La nature nous en fournit de nombreux exemples: acides lactique du lait aigri, malique des pommes avant maturité (diacide-monoalcool), tartrique du tartre des vins (diacide-diacool), citrique du citron (triacide-monoalcool), etc. Ces derniers, d’une saveur aigrelette agréable interviennent dans la fabrication de produits alimentaires.Cristallisant facilement, ils comptent parmi les premiers composés organiques isolés et étudiés. Leur nomenclature officielle résulte de celle des acides carboxyliques (alcanoïque), à laquelle on ajoute le suffixe -ol suivi de la position occupée par la fonction alcool sur la chaîne. Une nomenclature courante les désigne comme acide 見-, 廓-, 塚-...alcool. L’acide lactique CH3 漣CHOH 漣COOH est appelé propanol-2-oïque; c’est un acide 見-alcool.Modes d’obtentionLes modes d’obtention se distinguent par la position relative des deux fonctions.Les acides 見-alcools sont obtenus par trois voies principales:– oxydation nitrique ménagée d’un 見-glycol: l’éthylène glycol est ainsi transformé en acide glycolique ou éthanol-2-oïque;– hydrolyse d’un acide 見-halogéné: l’acide lactique est obtenu par hydrolyse alcaline de l’acide 見-chloropropionique;– hydrolyse d’un nitrile 見-alcool appelé cyanhydrine 見 résultant de l’addition, sur un aldéhyde, de l’acide cyanhydrique.Les acides 廓-alcools sont préparés par trois méthodes principales:– hydratation, en milieu alcalin, des acides 見-éthyléniques;– hydrolyse d’un nitrile 廓-alcool appelé cyanhydrine 廓, résultant de l’addition, sur un époxyde, de l’acide cyanhydrique ou de la substitution par l’ion cyanure du chlore d’une chlorhydrine 見: l’acide hydracrylique (hydroxy-3-propanoïque) est préparé par hydrolyse de l’éthylènecyanhydrine obtenue par cyanuration de la chlorhydrine du glycol;– hydrolyse des esters 廓-alcools obtenus par condensation d’un ester 見-halogéné sur un aldéhyde ou une cétone en présence de zinc; c’est la réaction de Réformatsky (réaction 1).On peut également les obtenir par l’hydrogénation catalytique des acides 廓-cétoniques
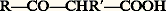 très accessibles par la condensation de Claisen et par l’hydrolyse de la 廓-lactone, formée par la cycloaddition, catalysée par un acide de Lewis, d’un aldéhyde ou d’une cétone sur le cétène.Les acides 塚-et 嗀-alcools n’existent comme tels qu’en solution aqueuse très diluée ou sous forme de sels alcalins, sinon ils se déshydratent spontanément en formant un ester interne cyclique appelé 塚- ou 嗀-lactone. Leur préparation, comme celle des lactones dont ils résultent par hydrolyse, peut-être réalisée par quatre voies principales:– hydrolyse alcaline des acides 塚- ou 嗀-halogénés;– cyclisation, en catalyse acide, des acides 塚- ou 嗀-éthyléniques: c’est l’estérification intramoléculaire d’un acide carboxylique par un alcène;– hydrogénation ménagée des anhydrides cycliques de 塚- ou 嗀-diacides par l’amalgame de sodium ou le zinc et l’acide acétique: réduction de l’anhydride glutarique en valérolactone;– oxydation de Baeyer-Villiger des cétones cycliques: préparation de la pentadécalactone ou exaltolide par oxydation à l’acide peroxosulfurique ou acide de Caro de la cyclopentadécanone (réaction 2).Propriétés physiquesLes monoacides-monoalcools sont des solides ou des liquides sirupeux plus solubles dans l’eau que les acides de même chaîne mais moins solubles qu’eux dans l’éther et les hydrocarbures.Propriétés chimiquesLes deux fonctions présentent les réactions normales des acides et des alcools. Leur interaction se manifeste par plusieurs réactions particulières:– leur acidité est exaltée par la présence, en 見- ou 廓-, d’une fonction alcool; ces composés bifonctionnels forment, avec les métaux de transition, des sels dans lesquels le cation métallique est complexé (formule 3): la solution aqueuse n’est pas conductrice du courant et sa couleur est différente de celle des sels cuivriques;– les acides 見-alcools primaires et secondaires, comme les acides glycolique et lactique, ont tendance à s’estérifier par chauffage en un mélange d’esters intermoléculaires linéaires (acide polyglycolique) ou cycliques appelés lactides (formules 4); un chauffage plus important ou un traitement par l’acide sulfurique concentré décompose ces derniers en monoxyde de carbone et aldéhyde;– les acides 見-alcools tertiaires se déshydratent facilement en acides 見-éthyléniques par chauffage; les acides 廓-alcools en acides 見-et 廓-éthylénique, dans un milieu acide; dans ce dernier cas, l’acide hydracrylique se transforme en acide acrylique.– les acides 塚- et 嗀-alcools subissent très facilement une estérification intramoléculaire qui conduit aux 塚- et 嗀-lactones.Les 塚- et les 嗀-lactones sont des esters cycliques qui présentent, par rapport aux esters acycliques, une réactivité particulièrement élevée. En milieu basique, ces lactones conduisent à des acides 塚- et 嗀-substitués, par attaque du nucléophile sur le carbone alkyle. En milieu acide par contre, l’attaque se porte sur la fonction carbonyle. La réduction des 塚-lactones, par l’amalgame de sodium en milieu aqueux, conduit aux glycols-1,4 par l’intermédiaire d’un hémiacétal de l’aldéhyde-alcool (réaction 5). Les lactones macrocycliques (cf. exaltolide dans la réaction 2) possèdent des propriétés olfactives qui les font employer en parfumerie (muscs).Stéréo-isomérieLes acides 見-alcools secondaires:
très accessibles par la condensation de Claisen et par l’hydrolyse de la 廓-lactone, formée par la cycloaddition, catalysée par un acide de Lewis, d’un aldéhyde ou d’une cétone sur le cétène.Les acides 塚-et 嗀-alcools n’existent comme tels qu’en solution aqueuse très diluée ou sous forme de sels alcalins, sinon ils se déshydratent spontanément en formant un ester interne cyclique appelé 塚- ou 嗀-lactone. Leur préparation, comme celle des lactones dont ils résultent par hydrolyse, peut-être réalisée par quatre voies principales:– hydrolyse alcaline des acides 塚- ou 嗀-halogénés;– cyclisation, en catalyse acide, des acides 塚- ou 嗀-éthyléniques: c’est l’estérification intramoléculaire d’un acide carboxylique par un alcène;– hydrogénation ménagée des anhydrides cycliques de 塚- ou 嗀-diacides par l’amalgame de sodium ou le zinc et l’acide acétique: réduction de l’anhydride glutarique en valérolactone;– oxydation de Baeyer-Villiger des cétones cycliques: préparation de la pentadécalactone ou exaltolide par oxydation à l’acide peroxosulfurique ou acide de Caro de la cyclopentadécanone (réaction 2).Propriétés physiquesLes monoacides-monoalcools sont des solides ou des liquides sirupeux plus solubles dans l’eau que les acides de même chaîne mais moins solubles qu’eux dans l’éther et les hydrocarbures.Propriétés chimiquesLes deux fonctions présentent les réactions normales des acides et des alcools. Leur interaction se manifeste par plusieurs réactions particulières:– leur acidité est exaltée par la présence, en 見- ou 廓-, d’une fonction alcool; ces composés bifonctionnels forment, avec les métaux de transition, des sels dans lesquels le cation métallique est complexé (formule 3): la solution aqueuse n’est pas conductrice du courant et sa couleur est différente de celle des sels cuivriques;– les acides 見-alcools primaires et secondaires, comme les acides glycolique et lactique, ont tendance à s’estérifier par chauffage en un mélange d’esters intermoléculaires linéaires (acide polyglycolique) ou cycliques appelés lactides (formules 4); un chauffage plus important ou un traitement par l’acide sulfurique concentré décompose ces derniers en monoxyde de carbone et aldéhyde;– les acides 見-alcools tertiaires se déshydratent facilement en acides 見-éthyléniques par chauffage; les acides 廓-alcools en acides 見-et 廓-éthylénique, dans un milieu acide; dans ce dernier cas, l’acide hydracrylique se transforme en acide acrylique.– les acides 塚- et 嗀-alcools subissent très facilement une estérification intramoléculaire qui conduit aux 塚- et 嗀-lactones.Les 塚- et les 嗀-lactones sont des esters cycliques qui présentent, par rapport aux esters acycliques, une réactivité particulièrement élevée. En milieu basique, ces lactones conduisent à des acides 塚- et 嗀-substitués, par attaque du nucléophile sur le carbone alkyle. En milieu acide par contre, l’attaque se porte sur la fonction carbonyle. La réduction des 塚-lactones, par l’amalgame de sodium en milieu aqueux, conduit aux glycols-1,4 par l’intermédiaire d’un hémiacétal de l’aldéhyde-alcool (réaction 5). Les lactones macrocycliques (cf. exaltolide dans la réaction 2) possèdent des propriétés olfactives qui les font employer en parfumerie (muscs).Stéréo-isomérieLes acides 見-alcools secondaires: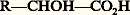 sont des molécules chirales qui existent sous deux formes énantiomères ou inverses optiques, la nature en fournissant parfois trois: R, S et racémique (cf. STÉRÉOCHIMIE – stéréochimie organique). C’est le cas de l’acide lactique qui est obtenu sous sa forme racémique par fermentation du lactose du lait sous l’action de Lactobacillus lactis , tandis que l’acide sarcolactique, formé dans les muscles pendant un effort, est l’isomère S dextrogyre pur (formule 6).Sous l’action de la potasse, les énantiomères se racémisent rapidement.Principaux acides-alcoolsL’acide glycolique (formule 7 a) existe dans les fruits verts ainsi que dans la canne à sucre. L’acide lactique qui, sous sa forme dextrogyre (S) participe au cycle de dégradation des sucres ou glycolyse et de leur reformation ou glycogenèse dans l’organisme, est un produit fabriqué industriellement par fermentation de polysaccharides; il est utilisé dans l’industrie alimentaire et en tannerie. L’acide malique (S lévogyre) se trouve dans les pommes non mûres et les groseilles vertes (formule 7 c). L’acide tartrique , possédant deux centres chiraux, se rencontre sous 4 formes stéréo-isomères: l’acide (2R, 3R) dextrogyre , qui est le produit naturel le plus abondant, existe en particulier dans de nombreux fruits et est un constituant du vin; l’acide (2S, 3S) lévogyre , inverse optique du précédent; le mélange racémique des deux qui fut séparé sous forme de sel double de sodium et d’ammonium, par triage des cristaux, par Pasteur en 1858 est fabriqué industriellement par hydroxylation oxydante de l’anhydride maléique; et enfin l’acide mésotartrique (2R, 3S) optiquement inactif (formule 7 b). L’acide citrique , abondant dans de nombreux fruits comme le citron, l’orange, l’ananas, la groseille et la fraise est optiquement inactif. C’est un intermédiaire important du cycle de la nutrition. Il est utilisé dans l’industrie alimentaire (formule 7 d).
sont des molécules chirales qui existent sous deux formes énantiomères ou inverses optiques, la nature en fournissant parfois trois: R, S et racémique (cf. STÉRÉOCHIMIE – stéréochimie organique). C’est le cas de l’acide lactique qui est obtenu sous sa forme racémique par fermentation du lactose du lait sous l’action de Lactobacillus lactis , tandis que l’acide sarcolactique, formé dans les muscles pendant un effort, est l’isomère S dextrogyre pur (formule 6).Sous l’action de la potasse, les énantiomères se racémisent rapidement.Principaux acides-alcoolsL’acide glycolique (formule 7 a) existe dans les fruits verts ainsi que dans la canne à sucre. L’acide lactique qui, sous sa forme dextrogyre (S) participe au cycle de dégradation des sucres ou glycolyse et de leur reformation ou glycogenèse dans l’organisme, est un produit fabriqué industriellement par fermentation de polysaccharides; il est utilisé dans l’industrie alimentaire et en tannerie. L’acide malique (S lévogyre) se trouve dans les pommes non mûres et les groseilles vertes (formule 7 c). L’acide tartrique , possédant deux centres chiraux, se rencontre sous 4 formes stéréo-isomères: l’acide (2R, 3R) dextrogyre , qui est le produit naturel le plus abondant, existe en particulier dans de nombreux fruits et est un constituant du vin; l’acide (2S, 3S) lévogyre , inverse optique du précédent; le mélange racémique des deux qui fut séparé sous forme de sel double de sodium et d’ammonium, par triage des cristaux, par Pasteur en 1858 est fabriqué industriellement par hydroxylation oxydante de l’anhydride maléique; et enfin l’acide mésotartrique (2R, 3S) optiquement inactif (formule 7 b). L’acide citrique , abondant dans de nombreux fruits comme le citron, l’orange, l’ananas, la groseille et la fraise est optiquement inactif. C’est un intermédiaire important du cycle de la nutrition. Il est utilisé dans l’industrie alimentaire (formule 7 d).
● acide-alcool, acides-alcools nom masculin Composé organique renfermant une (ou plusieurs) fonction(s) acide et une (ou plusieurs) fonction(s) alcool. (De nombreux acides-alcools interviennent dans les processus biochimiques.)
Encyclopédie Universelle. 2012.
